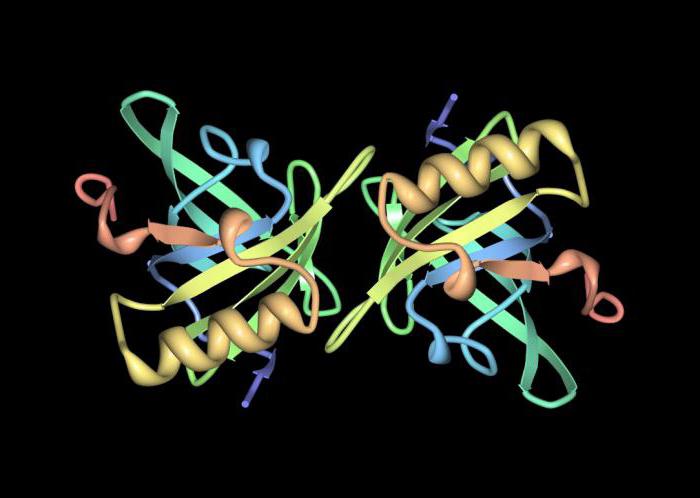
Baltymų molekulės arba baltymo struktūros struktūros organizavimo lygiai
Baltymų molekulės struktūra yra ištirta daugiau nei 200metai. Jis žinomas dėl daugelio baltymų. Kai kurie iš jų yra sintezuoti (pavyzdžiui, insulinas, RNazė). Pagrindinis struktūrinis ir funkcinis vienetas baltymų molekulių iš amino rūgščių. Be to, karboksilo ir amino grupės ir baltymai yra kitas funkcines grupes, kurios nustatyti jų savybių. Tokias grupes sudaro dedamas į šoninio branchings baltymų molekulės: karboksi grupė asparto rūgštimi arba glutamo rūgšties, amino grupės lizino arba hidroksilizinas, guanidino grupės arginino, imidazolo grupė histidino, hidroksilo grupė serino ir treonino, fenolio grupė tirozino, sulfhidrilo grupė cisteino, disulfido grupė cistino, tioeterio metionino grupė, fenilalaninas benzelnoe branduolys, alifatinių grandinės kitų amino rūgščių.
Yra keturi baltymų molekulės struktūros organizavimo lygiai.
Pagrindinė baltymo struktūra. Aminorūgštys baltymų molekulėje sujungtos peptidinėmis jungtimis, sudarant pirminę struktūrą. Tai priklauso nuo aminorūgščių kokybinės sudėties, jų skaičiaus ir ryšio tarpusavio seka. Pirminę baltymo struktūrą dažniausiai nustato Sengeras. Bandomasis baltymas yra apdorojamas ditrofluorobenzeno tirpalu (DNP), dėl kurio susidaro dinitrofenilo baltymas (DNP-baltymas). Vėliau DNP baltymas yra hidrolizuojamas, susidaro baltymų molekulės ir DNP-amino rūgšties likučiai. DNP-aminorūgštis yra izoliuota iš šio mišinio ir yra hidrolizuota. Hidrolizės produktai yra aminorūgštys ir dinitrobenzenas. Likusi baltymo molekulė reaguoja su naujais DNP dalimis, kol visa molekulė suskaido į aminorūgštis. Remiantis kiekybiniu aminorūgščių tyrimu, atliekamas atskirų baltymų pirminės struktūros schema. Pagrindinė baltymų struktūra yra insulinas, mioglobinas, hemoglobinas, gliukagonas ir daugelis kitų).
Edmano metodu baltymas yra apdorojamas fenilizotiocianatu. Kartais naudojami proteolitiniai fermentai - tripsinas, pepsinas, chimotripsinas, peptidazė ir tt.
Antrinė baltymų struktūra. Amerikos mokslininkai, taikydami Rentgeno spindulių difrakcijos analizę, nustatė, kad baltymo polipeptidų grandinės dažnai būna alfa spiralės formos ir kartais beta struktūros.
Alfa spiralės yra lyginamos su spiraliniais laiptais,kur laipsnių funkcija atliekama aminorūgščių likučiais. Fibrilinių baltymų molekulėse (šilko fibrozė) polipeptidų grandinės yra beveik visiškai ištemptos (beta struktūros) ir dedamos kaip sferos, stabilizuotos vandenilio ryšiais.
Alfa spiralė gali spontaniškai formuotissintetiniai polipeptidai (dederonas, nailonas), kurių molekulinė masė yra nuo 10 iki 20 tūkstančių Da. Tam tikrose baltymų molekulės vietose (insulinas, hemoglobinas, RNAazė) sutrinka peptidų grandinės alfa spiralinė konfigūracija ir susidaro kitokio tipo spiralinės struktūros.
Tretinė baltymo struktūra. Baltosios molekulės polipeptidų grandinės spiralės skyriai yra skirtingi santykiai, kurie lemia tretinio (trimačio) struktūrą, sudaro baltymų molekulės tūrį ir formą. Manoma, kad tretinė struktūra atsiranda automatiškai dėl aminorūgščių radikalų sąveikos su tirpiklio molekulėmis. Šiuo atveju hidrofobiniai radikalai "traukia" į baltymų molekulę, formuojasi jų sausos zonos, o hidrofilinės grupės orientuotos į tirpiklį, o tai sukelia energetiškai palankų molekulės patvirtinimą. Šis procesas lydi tarpdisciplininių jungčių formavimąsi. Beta molekulės tretinė struktūra yra iššifruojama RNa, hemoglobino, lizocimo viščiukų kiaušiniui.
Ketvirtinė baltymų struktūra. Šios baltymo molekulės struktūros rūšis atsiranda dėl kelių asociacijų susiejimo į vieną kompleksinę molekulę. Kiekvienas subvienetas turi pirminę, antrinę ir tretinę struktūrą.
</ p>>