Struktūrinė ir molekulinė formulė: acetilenas
Acetileno struktūros ypatybės priklauso nuo jo savybių, gamybos ir taikymo. Tradicinis cheminės medžiagos pavadinimas - C2H2 Ar paprasčiausias ir bendras formulė. Acetilenas yra sudarytas iš dviejų anglies atomų, tarp kurių yra trigubas ryšys. Jo buvimas atspindi skirtingas etileno molekulės formules ir modelius, leidžiančius suprasti struktūros įtaka medžiagos savybėms.
Alkinai. Bendra formulė. Acetilenas
Alkilo angliavandeniliai arba acetilenas yraaciklinis, neprisotintas. Anglies atomų grandinė nėra uždaryta, joje yra paprastų ir daugialypių ryšių. Alkilų sudėtis atspindi santraukos formulę CnH2n - 2. Šios klasės medžiagų molekulėse yraviena ar kelios trigubos obligacijos. Acetileno junginiai reiškia nesotiejus junginius. Tai reiškia, kad dėl vandenilio susidaro tik vienas anglies valentas. Likusios trys jungtys naudojamos bendraujant su kitais anglies atomais.
Pirmasis ir labiausiai žinomas atstovasalkilai-acetilenas arba etinas. Trivialus medžiagos pavadinimas kilęs iš lotyniško žodžio "acetum" - "actas" ir graikų kalba - "hyle" - "medis". Homologinės serijos steigėjas buvo atrastas 1836 m. Cheminiuose eksperimentuose, o vėliau medžiaga sintezuota iš anglies ir vandenilio E. Davy ir M. Bertlo (1862). Esant normaliai temperatūrai ir normaliam atmosferos slėgiui acetilenas yra dujinės būklės. Tai bevandenė, bekvapė, lengvai tirpi vandenyje. Etinas yra lengviau tirpus etanolyje ir acetone.

Acetileno molekulinė formulė
Etinas - paprasčiausias jo homologinių serijų narys, jo sudėtis ir struktūra atspindi šias formules:
- C2H2 - etano kompozicijos molekulinis įrašymas, kuris suteikiakad medžiagą sudaro du anglies atomai ir tas pats skaičius vandenilio atomų. Pagal šią formulę galima apskaičiuoti junginio molekulinę ir molinę masę. P. (Nuo2H2) = 26 a. e. m., M (C2H2) = 26,04 g / mol.
- Н: С ::: С: Н - acetileno elektronų taškų formulė. Panašūs vaizdai, vadinami "Lewiso struktūromis", atspindi elektroninę molekulinę struktūrą. Rašant reikia laikytis taisyklių: vandenilio atomas paprastai turi haliesto valentinės apvalkalo konfigūraciją formuojant cheminę jungtį, o kitus elementus - išorinių elektronų oktetu. Kiekviena gaubtinė žievė reiškia bendrą dviem atomais arba nesusituokusių išorinių energijos lygių elektronų poras.
- H-C≡C-H yra acetileno struktūrinė formulė, atspindinti ryšį tarp atomų ir jų eiliškumą. Viena briauna pakeičia porą elektronų.
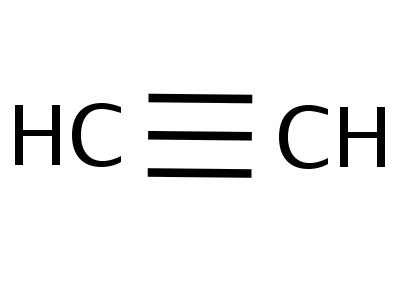
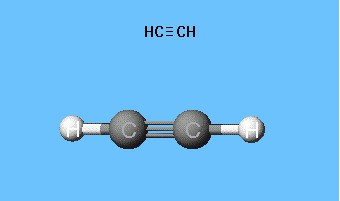
Acetileno molekulės modeliai
Formulės, rodančios elektronų pasiskirstymą,tarnavo kaip atominių orbitinių modelių, erdvinių molekulių formų (stereocheminių) kūrimo pagrindas. Dar XVIII a. Pabaigoje plačiai paplitė sferinių strypų modeliai - pavyzdžiui, skirtingos spalvos ir dydžio kamuoliukai, žymintys anglį ir vandenilį, kurie sudaro acetileną. Molekulės struktūrinė formulė yra formos strypų, kurie simbolizuoja cheminių ryšių ir jų skaičių kiekviename atomai.
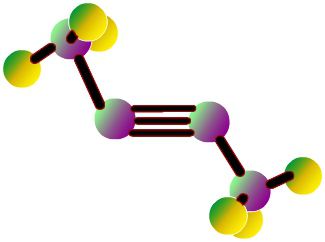
Atitilo reprodukcijos sferinis modelisvalentingumo kampai lygūs 180 °, bet tarpukario atstumai molekulėje atsispindi maždaug. Tarp kamuoliuko tarpus nėra sukurtas atomų elektronų tankio užpildymo vaizdas. Trūkumas yra pašalinamas Driding modeliuose, kurie žymi atomų branduolius ne su kamuoliukais, o juostų pritvirtinimo taškus tarpusavyje. Šiuolaikiniai volumetriniai modeliai suteikia ryškesnes idėjas apie atominius ir molekulinius orbitalius.
Acetieno hibridiniai atominiai orbitalai
Anglijoje susiliečiančioje būsenoje yra trys p-orbitaliai, o vienas - nespaustu elektronu. Metano (CH4) jie dalyvauja kuriant lygiavertęryšiai su vandenilio atomais. Garsusis amerikiečių tyrėjas L. Paulingas sukūrė atominių orbitėlių (AO) hibridinės būklės teoriją. Anglies cheminių reakcijų apibūdinimas yra AO išlygiavimas formoje ir energijoje, naujų debesų susidarymas. Hibridiniai orbitalai suteikia stipresnių jungčių, formulė tampa stabilesnė.
Atomų anglis acetileno molekulėje, priešingai neimetanas, vyksta sp-hibridizacija. S ir p elektronai sumaišomi formos ir energijos. Atsiranda du sp-orbitiniai elementai, kurie guli 180 ° kampu, nukreipti į priešingą branduolio pusę.

Trivietis ryšys
Acetileno mišriuose elektroniniuose anglies debesuosedalyvauti σ-obligacijų sukūrime su tais pačiais kaimyniniais atomais ir su vandeniliu CH-porose. Išlieka du ne hibridiniai p-orbitaliai statmenai vienas kitam. Etileno molekulėje jie dalyvauja formuojant dvi π-ribas. Kartu su σ yra trigubas ryšys, atspindintis struktūrinę formulę. Acetilenas skiriasi nuo etano ir etileno atstumu tarp atomų. Trikampis ryšys yra trumpesnis nei dvigubas, bet turi didesnį energijos rezervą, yra tvirtesnis. Didžiausias σ- ir π-ryšių tankis yra statmenose srityse, o tai veda prie cilindrinio elektroninio debesies susidarymo.
Atitilo cheminės jungties ypatybės
Etileno molekulė yra linijinė forma, kuri yra sėkmingaatspindi cheminę acetileno formulę - H-C≡C-H. Anglies ir vandenilio atomai išilgai tiesios linijos, tarp jų yra 3 σ- ir 2 π-jungtys. Laisvas judėjimas, sukimasis išilgai C-C ašies yra neįmanomas, tai trukdo kelias obligacijas. Kitos trikampio ryšio savybės:
- elektronų porų, jungiančių du anglies atomus, skaičius yra 3;
- ilgis - 0.120 nm;
- Plyšio energija yra 836 kJ / mol.
Palyginimui: Padidinto etano ir etileno vieną ilgio ir dvigubo cheminio ryšio molekulių - 1,54 ir 1,34 nm, atitinkamai, energetikos plyšiai, C-C yra 348 kJ / mol, C = C - 614 kJ / mol.

Acetileno homologai
Acetilenas yra paprasčiausias alkilų atstovas, kurio molekulės taip pat turi trigubą jungtį. Propyn CH3С≡СН - ацетилен гомолог. Trečiojo alkiino atstovo formulė - Butin-1-CH3CH2С≡СН. Acetilenas yra nereikšmingas etano pavadinimas. Sisteminei alkilų nomenklatūrai taikomos IUPAC taisyklės:
- linijinės molekulės nurodyta, kad pagrindinėje grandinėje, kurį sukėlė Graikijos skaitmuo vardą, į kurį yra pridedama priesaga -IN ir atominis skaičius su trigubą jungtį, pvz, etinilo, propinilo, butin-1;
- pagrindinės atomų grandinės numeracija prasideda molekulės, arčiausiai trijų ryšių, pabaigoje;
- šakotosioms angliavandeniliams pirmiausia seka šoninio filialo pavadinimas, po kurio eina pagrindinės atomų grandinės pavadinimas su priesaga -in.
- paskutinė pavadinimo dalis - paveikslėlis, nurodantis trikampio ryšio vietą molekulėje, pavyzdžiui, butinu-2.
Alkiinų izomerizacija. Savybių priklausomybė nuo struktūros
Etienas ir propinas neturi trigubo izomerojie pasirodo, pradedant Butinu. Anglies skeleto izomerai yra pentinui ir tokiems homologams. Acetileninių angliavandenilių erdvinė izomerizacija nėra pasireiškusi trijų ryšių atžvilgiu.
Pirmieji 4 etanolio homologai yra vandenyje sunkiai tirpios dujos. Acetileno angliavandeniliai5 - C15 - skystis. Kietosios medžiagos yra etano homologai, pradedant angliavandeniliu C17. Cheminė alkilinų prigimtisreikšminga trikampio ryšio įtaka. Tokio tipo angliavandeniliai yra aktyvesni už etileną ir yra pridedamos įvairios dalelės. Šis turtas grindžiamas plačiu etano naudojimu pramonėje ir inžinerijoje. Deginant acetileną išleidžiamas didelis šilumos kiekis, kuris randamas metalų pjaustymui ir suvirinimui.
</ p>>